La cancrosis es una enfermedad que afecta a los cítricos en las áreas de climas cálidos y húmedos, especialmente donde ocurren lluvias abundantes en verano. Causa un daño directo por las lesiones que provoca en la fruta y el resto de los órganos aéreos de la planta.
La pérdida económica más importante es causada por las restricciones cuarentenarias a los frutos de áreas infectadas impuestas por los países libres de la enfermedad.
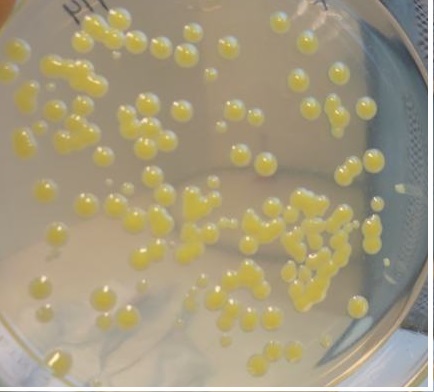
Es causada por Xanthomonas citri pv. citri, una bacteria gram negativa, no esporulada, que desarrolla en medio de cultivo, colonias amarillas, viscosas, insolubles en agua, redondeadas, convexas, brillantes y de bordes lisos (Figura 1).
Sintomatología
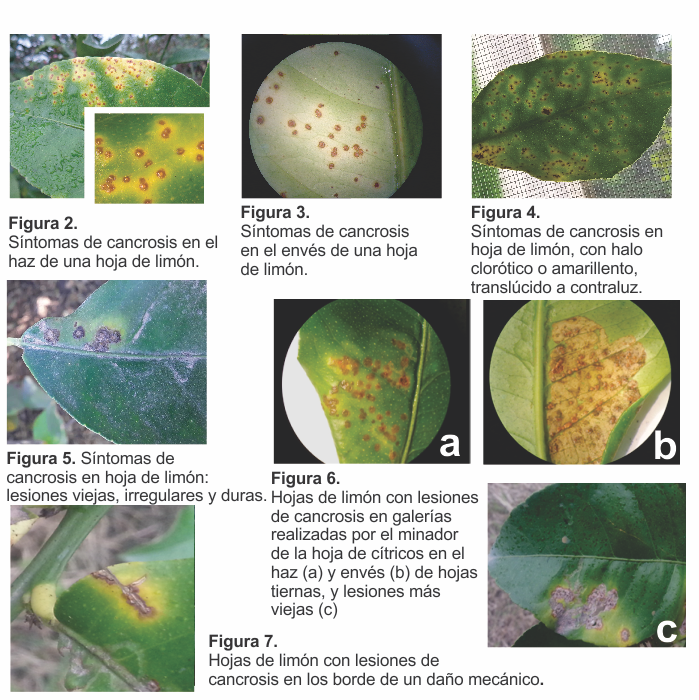
En hojas, las lesiones comienzan como manchas pequeñas, redondeadas, de aspecto aceitoso o húmedo. Luego evolucionan a pústulas con aspecto eruptivo, corchoso, de color amarillo claro, que se tornan marrones al desarrollar tejidos suberificados, visibles en ambas caras de las hojas (Figuras 2 y 3). Una zona húmeda de apariencia aceitosa, rodea a las lesiones en forma de halo clorótico o amarillento, translúcido a contraluz (Figura 4). Las lesiones suelen alcanzar 3-5 mm de diámetro y pueden unirse tomando formas irregulares, que se endurecen y aparecen rugosas por el haz y el envés (Figura 5). Es común observar lesiones de cancrosis asociadas a daños, principalmente de minador de los cítricos (Phyllocnistis citrella) (Figura 6), y daños mecánicos (Figura 7).
Las lesiones en las ramas son similares a las de las hojas pero más chatas y alargadas con un centro necrótico, y son más prominentes en las ramas viejas (Figura 8).
En frutos pequeños, los cancros pueden tener 2-5 mm de diámetro, aunque pueden unirse afectando áreas importantes de la epidermis (Figura 9). Tienen apariencia suberificada y crateriforme. El halo clorótico suele ser menos definido que en las hojas y el anillo de aspecto aceitoso en los márgenes se observa siempre en las lesiones incipientes (Figura 10). Con el envejecimiento, las lesiones se vuelven más oscuras (Figura 11). Al realizar un corte transversal de la fruta se observa que la lesión profundiza en la cáscara (Figura 12).
La bacteria sobrevive en tejidos vegetales enfermos, los que conforman la principal fuente de inóculo. Puede sobrevivir largos períodos en la corteza de troncos y ramas. También puede sobrevivir como epifita en plantas hospedantes y no hospedantes, y como saprofita en cubiertas vegetales o en el suelo. La bacteria invernante causa nuevas infecciones en primavera, generando grandes cantidades de bacterias.
La dispersión a corta distancia ocurre con la lluvia impulsada por el viento y las salpicaduras de agua en una misma planta o entre plantas; y a larga distancia, con el movimiento de material de propagación infectado (yemas y plántulas).
Para que se desarrolle la enfermedad deben estar presentes simultáneamente y por un lapso de tiempo adecuado:
- La bacteria: si bien puede estar en forma saprofítica sobre tejido asintomático, la principal fuente de inóculo son las lesiones en hojas, ramas y frutos de la campaña anterior, y de la misma campaña debido a que es policíclica.
- Tejido susceptible: son más susceptibles las plantas jóvenes o más vigorosas porque la bacteria infecta tejido tierno, ingresando por aberturas naturales; y los tejidos con daños de granizo, minador, ramaleo, etc., al facilitarse el ingreso de la bacteria por las heridas. Las hojas y tallos dañados por el minador son muy propensos a ser infectados porque el insecto forma galerías de alimentación por donde ingresa gran cantidad de bacteria ocasionando un mayor número de lesiones y área infectada.
- Condiciones ambientales predisponentes :
- Humedad en superficie.
- Temperaturas entre 20°C y 30°C.
- Lluvias con vientos, que generan la presión necesaria sobre la planta para la penetración de la bacteria y además producen heridas.
Patotipos presentes en el mundo
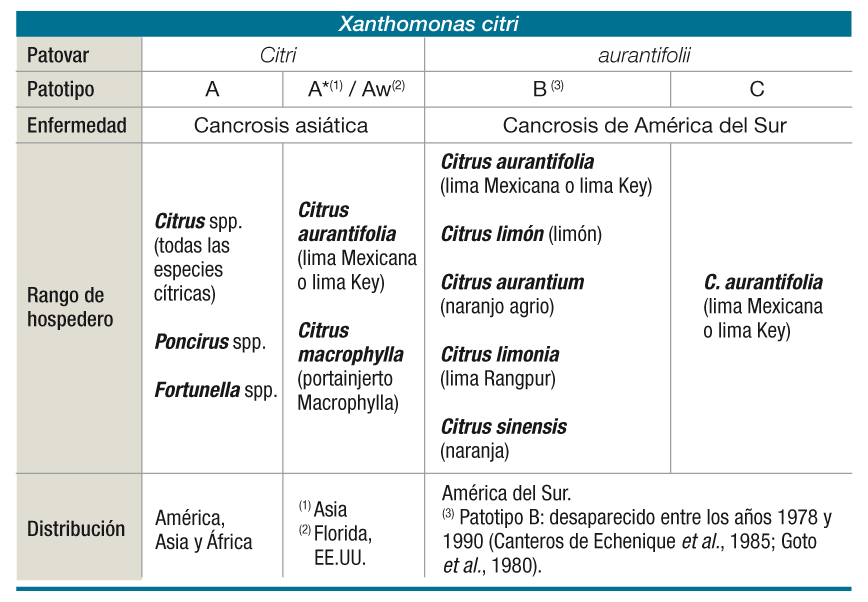
Las cepas de Xanthomonas patógenas para los cítricos se reclasificaron como especies distintas ya que difieren en sintomatología, rango de hospedadores e importancia económica.
El patotipo A es el agente causal de la cancrosis de los cítricos, reclasificado como X. citri pv. citri (sinónimos X. citri subsp. citri o X. axonopodis pv. citri). Se identificaron además, cepas atípicas: A* (en Asia) y Aw (en Florida, EE.UU.) afectando a Citrus aurantifolia (lima Mexicana o lima Key) y Citrus macrophylla.
El patotipo D fue reclasificado como Xanthomonas fuscans subsp. aurantifolii; y el E como Xanthomonas alfalfae subsp. citrumelonis.
Diagnóstico
Un correcto diagnóstico de cancrosis es fundamental debido principalmente al carácter cuarentenario. Por ello, los Programas de Certificación de fruta cítrica de la Argentina para exportación a países donde el patógeno es cuarentenario, que incluyen la inspección de los frutos, se respaldan en análisis de laboratorio, existiendo una Red Nacional de Laboratorios autorizados y reconocidos por Senasa, que utilizan metodologías analíticas estandarizadas. Para cancrosis, el Laboratorio Reconocido en la Red en el país, es el laboratorio de Fitopatología de la EEAOC, inscripto en la Red en el año 2004.
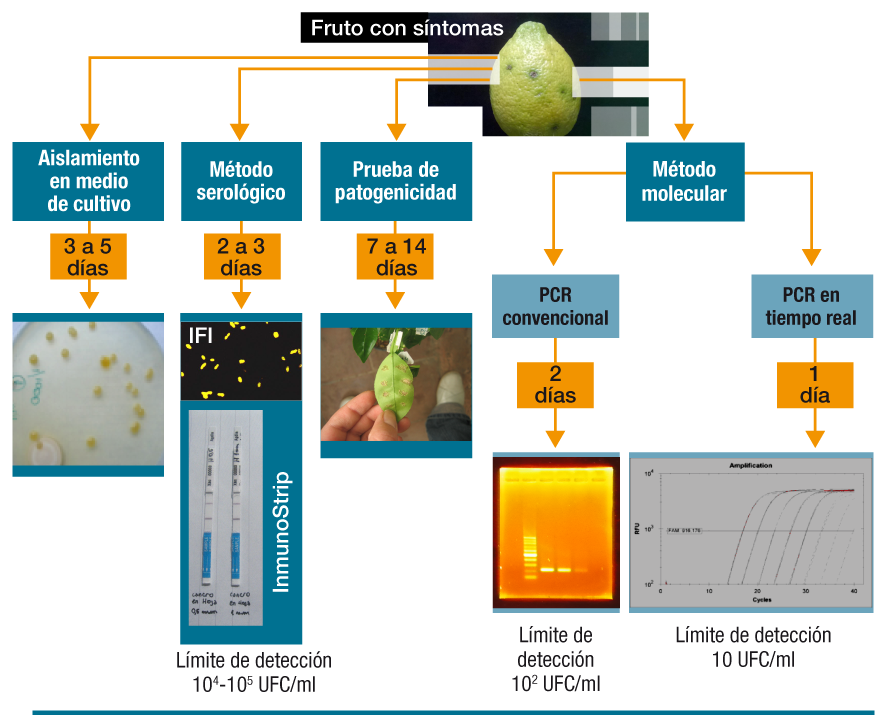
Si bien la sintomatología de cancrosis tiene características que permiten un fácil reconocimiento a simple vista pueden surgir dudas, siendo las confusiones más frecuentes con daños causados por granizo (Figura 13), u otros daños mecánicos, conocidos como “ramaleo” y daño de espina (Figura 14). Por ello se utilizan diversos métodos de diagnóstico (Figura 15), que son los siguientes:
Siembra y aislamiento en agar nutritivo: la bacteria es fácilmente cultivable, sin embargo requiere 2 a 5 días para desarrollar sus colonias y el medio de cultivo no es selectivo.
Serología: se utilizan anticuerpos policlonales o monoclonales. Algunos anticuerpos no son específicos y pueden reaccionar con especies de Xanthomonas no relacionadas con cancrosis, siendo otra desventaja, que algunos métodos requieren 2 a 3 días y no detectan bajas concentraciones de bacteria.
Pruebas de patogenicidad: permiten identificar los patotipos en plantas hospederas indicadoras. Su desventaja es que las lesiones desarrollan entre 7 y14 días post-inoculación.
Técnicas moleculares (PCR convencional o PCR en tiempo real): son más rápidas, sensibles y específicas. PCR en tiempo real tiene ventajas sobre la PCR convencional, ya que permite cuantificar el ADN, requiere menos tiempo (horas), es más sensible, y más específica cuando se utiliza sonda TaqMan.